G细胞在牙周炎中的临床应用
一、慢性牙周炎定义
牙周炎是一种慢性炎症性疾病,会逐渐破坏由牙周韧带、牙龈和牙槽骨组成的牙周组织。牙周炎是全球第六大流行慢性疾病,影响全球7.43亿人。牙周炎不仅是成人牙齿脱落的主要原因,还与多种慢性疾病(即糖尿病、肥胖、骨质疏松症、关节炎、抑郁症、心血管疾病和阿尔茨海默病)有关。
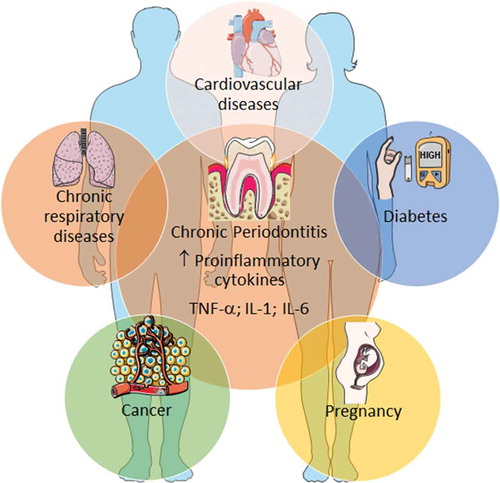
慢性牙周炎与多种慢性炎症性疾病有关[1](源引:Postgrad Med.2018)
二、慢性牙周炎的病理机制
牙周组织稳态取决于宿主免疫防御和微生物攻击之间的平衡。一旦菌群失调的微生物群落破坏了易感宿主,产生炎症对话。因此,菌群失调的微生物群充当一种病理体,过度激活炎症反应,引起“抗炎-促炎”、“成骨-破骨”等免疫反应平衡失调,引发与先天性和适应性免疫调节相关的牙周组织分解、牙槽骨的再吸收,牙齿脱落和全身并发症。
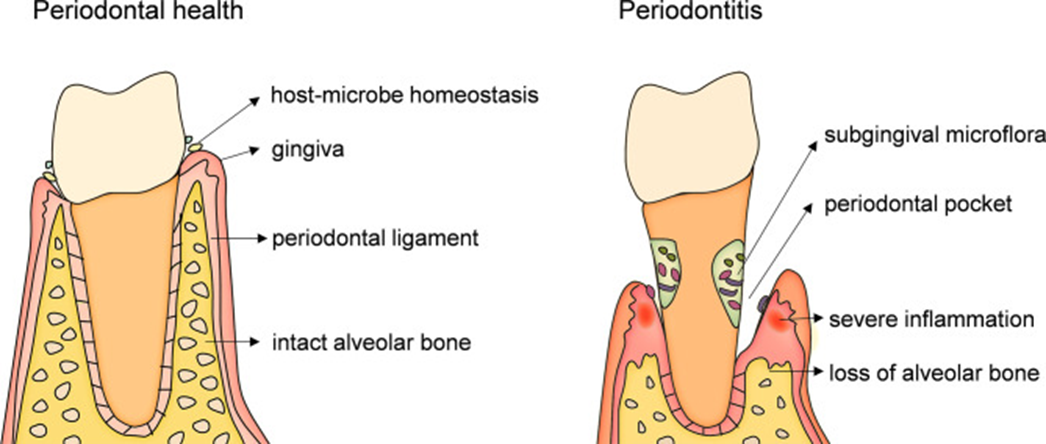
慢性牙周炎的病理改变[2](源引:Front Immunol.2022)
三、牙周炎的传统疗法:
非手术治疗:牙周炎初期的非手术治疗包括去除龈上及龈下的牙菌斑和牙石,并在局麻下通过刮治和根面平整术进行深度清洁,清除龈下致病菌。此外,次氯酸钠和洗必泰及适当的全身抗生素的使用也可以明显降低牙周炎病原体的数目,但容易复发。
手术治疗:经典的手术治疗中,翻瓣清创术是一种临床常用的方法之一。通过手术将龈瓣的一部分与底层骨组织分离,提供清创入路,增加治疗过程中对病变组织的可见性。
四、G细胞疗法在慢性牙周炎中应用
传统疗法侧重于利用天然和合成材料来填充牙周组织的缺损,但这些替代品并不能实际恢复组织的原始物理结构和功能。由于牙周组织的复杂性,目前的治疗手段虽然可以局部消除牙周炎症,控制疾病的进展,但却无法使损伤的牙周组织从形态及功能上恢复正常,牙周组织的再生仍然是一个挑战。基于G细胞的组织工程由于其突出的自我更新和分化为各类细胞的潜能,成为牙周再生技术最关键的部分,可以更大程度的控制与损伤过程相关的因素,在生物材料的加持下,在牙周组织再生方面取得了良好的成果。
一项为期12个月的准随机对照临床试验证实了自体牙周韧带源性间充质G细胞(PDL-MSCs)联合异体来源骨替代物(XBS)在治疗骨内牙周缺损的安全性和有效性。纳入20例患者,随机分为实验组(PDL-MSCs+XBS)和对照组(XBS),记录0、6、9和12个月的临床和影像学参数,无严重不良事件报告。实验组(n=9)患者的临床附着水平(CAL)增加(1.44,SD=1.87)和牙周袋深度(PPD)减少(2.33,SD=1.32)均高于对照组,说明将G细胞联合骨替代物治疗牙周缺损是安全的,术后发病率低,愈合适当。
总之,G细胞对于慢性牙周炎的治疗机制可分为如下几点:
1.广泛的免疫调节的旁分泌能力:G细胞通过分泌一些可溶性因子如TGFβ、吲哚胺-2,3-双加氧酶-1(IDO-1)、肝细胞生长因子(HGF)、前列腺素E2(PGE2)的分泌抑制T细胞增殖,还可通过刺激程序性细胞死亡蛋白1(PD-1)及其配体(PD-L1)的表达来实现抗炎功能[3]。
2.强大的组织再生能力:其突出的自我更新和分化为各类细胞的潜能,使G细胞成为牙周再生技术最关键的部分,可以更大程度的控制与损伤过程相关的因素,在生物材料的加持下,取得较高的临床价值。
3.广谱的抗菌作用:间充质G细胞对抗细菌感染的主要机制之一是通过释放抗菌肽。研究显示MSC产生抗菌肽主要包括LL-37、通过TLR4通路分泌β-defensin(防御素)、上调抗菌蛋白lipocalin2(脂质转运蛋白)和hepcidin(铁调素)[4],有趣的是,这些抗菌肽不仅由MSC产生,而且还可影响MSC的增殖、迁移和再生,级联放大MSC的抗菌作用,放线菌等侵袭性/进行性牙周炎相关致病菌,另外MSC可以触发中性粒细胞的杀菌功能。
目前关于间充质G细胞治疗慢性牙周炎的研究越来越多,特别是在生物材料的加持下,其临床应用价值越来越高,但目前临床反馈效果存在一定的分歧,需要扩大样本量、提高牙周检查标准化和更长的随访时间来确证其临床治疗效果[5]。相信在不久的将来随着研究的深入,G细胞疗法能给广大患者带来福音。
参考文献:
1.Cardoso EM, Reis C, Manzanares-Céspedes MC. Chronic periodontitis, inflammatory cytokines, and interrelationship with other chronic diseases. Postgraduate medicine 2018, 130(1): 98-104.
2. Feng Y, Chen Z, Tu SQ, Wei JM, Hou YL, Kuang ZL, et al. Role of Interleukin-17A in the Pathomechanisms of Periodontitis and Related Systemic Chronic Inflammatory Diseases. Frontiers in immunology 2022, 13: 862415.
3. Wang M, Xie J, Wang C, Zhong D, Xie L, Fang H. Immunomodulatory Properties of Stem Cells in Periodontitis: Current Status and Future Prospective. Stem cells international 2020, 2020: 9836518.
4. Silva-Carvalho A, Cardoso MH, Alencar-Silva T, Bogéa GMR, Carvalho JL, Franco OL, et al. Dissecting the relationship between antimicrobial peptides and mesenchymal stem cells. Pharmacol Ther 2022, 233: 108021.
5.Sánchez N, Fierravanti L, Núñez J, Vignoletti F, González-Zamora M, Santamaría S, et al. Periodontal regeneration using a xenogeneic bone substitute seeded with autologous periodontal ligament-derived mesenchymal stem cells: A 12-month quasi-randomized controlled pilot clinical trial. Journal of clinical periodontology 2020, 47(11): 1391-1402.