
细胞类药物研发难点
不同于传统药物,细胞药物最本质的特点是其“活”的特性,在体外培养时对营养和环境要求极为严苛,且在移植入人体之后仍然具有增殖、分化、分泌活性物质的功能。
这为细胞药物研发、生产和质量控制带来诸多难点,如:
①无法终末灭菌:要求采用全程无菌工艺;
②存储、运输条件严苛:低温存储,运输温度、震动均会对细胞活力产生影响;
③货架期短:新鲜细胞制剂通常有效期短;
④异质性:包括细胞来源、亚群差异、批间差异、非目的细胞对细胞活力产生影响;
⑤复杂性:工艺复杂、原辅包多样、质控内容繁多、临床应用门槛高等因素;
⑥产量受限:单一供体可生产制剂数量有限,有待开发规模化生产工艺。
因此,如何开展细胞类药物制造工艺的研发,如何实现细胞类药物良好的质量控制,成为细胞类成药过程中最核心的环节。
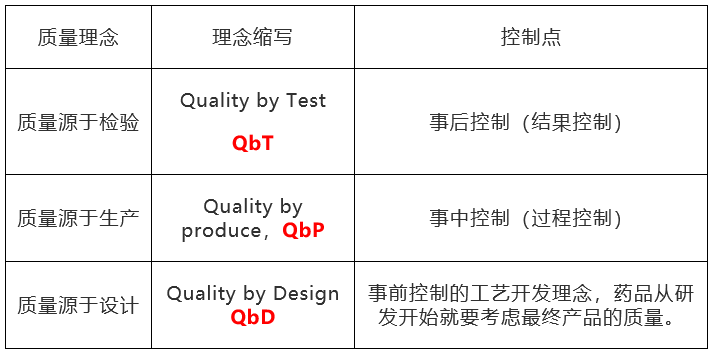
QbD理念
质量源于设计(Quality by Design, QbD)是指以合理的科学和质量风险管理为依据,起始于预定的质量目标,注重对产品和工艺的理解及对生产工艺过程控制系统的研发方法(ICHQ8)。
在制药行业,最早由FDA在2003年发表的“Pharmaceutical cGMPs for the 21st century – A Risk Based Approach”报告中正式提出,并且被ICH纳入到自己的质量体系,用了Q8~Q11等多个章节来解释和阐述QbD的内涵和运用方法。
在基于知识和风险评估的基础上,对配设计、工艺路线确定、工艺参数选择、物料控制等各个方面都要进行深入研究,积累翔实的数据,并依此确定最佳的产品配方和生产工艺。根据这种理念上的改变,要求药品质量监管的控制点要逐渐前移,从过去单纯依赖终产品检验,到对生产过程的控制,再到产品的设计和研究阶段的控制。简单讲,就是从源头上强化注册监管,确保药品质量和安全。
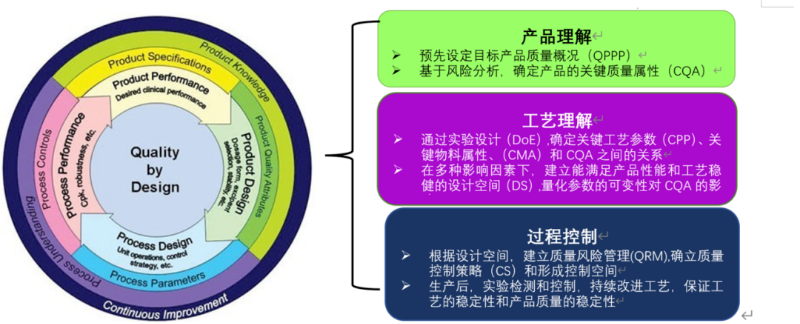
QbD理念及其实施流程图
细胞类药物实行QbD的益处
站在监管方角度,对于按照QbD理念开发的药品,监管部门可根据质量风险等级做出评估和明确的决定。
通过前期处方和工艺的认知和研究,FDA对质量控制过程中的风险来源与程度有了较为准确的把握,这将极大减少监管部门的工作量,提高办事效率。在传统的日常评审与监管中,由于处方或工艺变更带来的大量补充申请,耗费了FDA大量的人力、物力和财力。而实施QbD后,FDA对申报项目有了更深刻地了解,对DS范围内的操作变更有了更多信心,可不再进行审批,实行更为宽松的“弹性监管”,切实提高了监管效率。
站在企业角度,QbD虽前期投入大,但从长远来看,QbD的实施有利于企业节约生产成本、提高生产收益和劳动效率。传统生产中,由于没有经过合理科学的试验设计,没有确立CPP,没有建立DS,不合格产品在生产中时有发生,高额罚款和强制召回事件也频见报端。由于设备的改变、物料的变更、环境的差异及生产人员的经验不同,造成产品批次间质量的不稳定。这些可能迫使企业需进行生产变更,变更后的工艺需向监管部门进行补充申请。
实施QbD后,在DS内的改动不用提交补充申请,同时不合格产品和投诉都将大幅减少。此外,生产工艺的灵活性、质量管理的高水准,以及药品质量的高性能,为企业的市场竞争力增加砝码,为后续产品的开发奠定基础,为保护健康、造福社会承担企业自身的社会责任,这些都是企业愿意做的。
QbD的适用现状
目前,按照ICHQ8R2的要求,申报者应该在通用技术文件(CTD)的P.2章节中提交药品研发及相关信息,包括:
(1) QRM及产品和工艺研发:比如,在章节P.2.1、P2.2和P.2.3中可以描述物料属性和工艺参数对产品CQA的风险分析和相互关系,在章节P.2.3中可以描述生产工艺设计对产品质量的风险分析。
(2) DS:作为拟定生产工艺的一个要素,DS可在申报资料中有关生产工艺和过程控制的章节(P.3.3)予以介绍。如果需要,可在关键步骤和中间体控制的章节(P.3.4)中提供更多的信息。有关产品和生产工艺研发的章节(P.2.1、P.2.2和P.2.3)最适于总结和描述所有关于产品和工艺研发的研究,作为DS的依据。在制剂质量标准的论证章节(P.5.6)中,可以讨论DS与总体CS的关系。此外,还应提供CS和原料药相关信息。
在国内,2020年1月NMPA发布第6号公告:推荐申请人按照ICH《Q8(R2):药品研发》《Q9:质量风险管理》《Q10:药品质量体系》《Q11:原料药开发和生产(化学实体和生物技术/生物实体药物)》及问答文件的要求开展相关研究。
由此可见,目前国内并未强制要求企业在CTD文档中按照ICHQ8~Q11提交QbD资料。然而,随着国内在药物注册技术标准进一步与国际接轨,有理由相信,在不远的将来,“推荐适用”将很有可能修改为“适用”,届时无论小分子、大分子、生物制品还是细胞药物,都必须按照QbD理念进行研发、生产和质控,都必须在申报和注册的CTD提交QS及对应的制定依据。因此,当下就是实行QbD最好的时机。
名词注释
BLA:Biologic License Application,生物制品许可申请
FDA:Food and Drug Administration,美国食品药品监督管理局
IND:Investigational new drug,新药临床研究审批
QbD:Quality by Design,质量源于设计
QbT:Quality by Test,质量源于检验
QbP:Quality by Produce,质量源于生产
QTPP:Quality Target Product Profile,目标产品质量概况
CQA:Critical Quality Attribute,关键质量属性
DOE:Design of Experiment,实验设计
CPP:Critical Process Parameter,关键工艺参数
CMA:Critical Material Attribute,关键物料属性
DS:Design Space,设计空间
QRM:Quality Risk Management,质量风险管理
CS:Control Strategy,质量控制策略
PAT:Process Analytical Technology,过程分析技术
CTD: Common Technical Document,通用技术文件
NMPA:National Medical Products Administration,国家药品监督管理局
ICH:The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,人用药品技术要求国际协调理事会
参考文献
[1]ICH官网https://database.ich.org/sites/default/files/Q8_R2_Guideline.pdf
[2] FDA官网 https://www.fda.gov/media/77391/download
[3] Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8(4):315-7.
[4] Yang Y, Lee EH, Yang Z. Hypoxia-Conditioned Mesenchymal Stem Cells in Tissue Regeneration Application. Tissue Eng Part B Rev. 2022 Oct;28(5):966-977