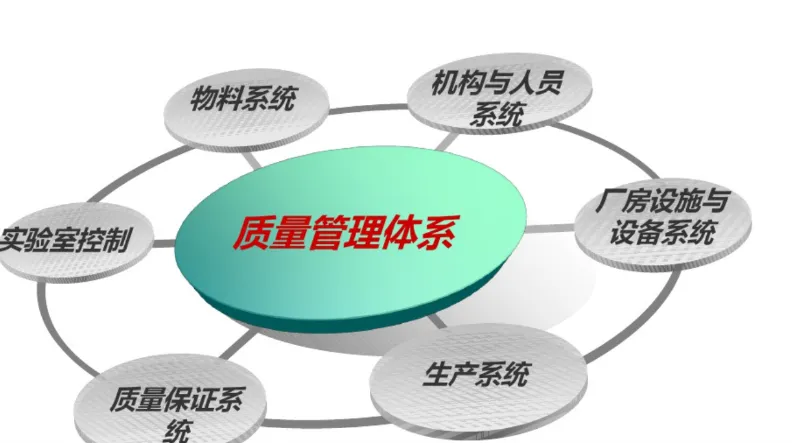
药品研发质量管理体系

药品研发是一个复杂的过程,包括不同的阶段,不同的的阶段都有不同的法规要求,所以在不同阶段要遵守相应的法规要求,但此时要恰到好处,不能矫枉过正,当过度时会束缚研发的脚步,影响研发的进度,但过于放松管理,会出现研发质量管理控制不到位,研发中的数据不太可靠。因此药品研发的不同阶段要建立适应当前发展阶段的质量体系。
研发阶段分为三个阶段:早期、中期、后期。依据研发的不同阶段,质量体系的也可以分为非GMP、GMP-like、全GMP。

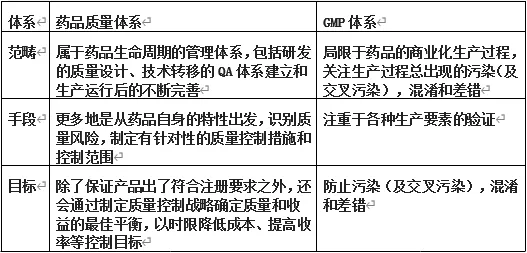
下表为药品质量体系和GMP体系范畴、手段、目标的差异
研发的质量管理也应从研发风险的角度去考虑,但在不同的研发阶段,要求也不相同,研发质量要在符合法规的大前提下兼顾研发效率,要平衡质量管理和项目管理,对于研发质量体系实施的关键就是要事前先详细布控(包括项目计划,流程,任务,完成时间,合格标准等),事后审核放行(根据流程进行关键节点的审核和放行)。
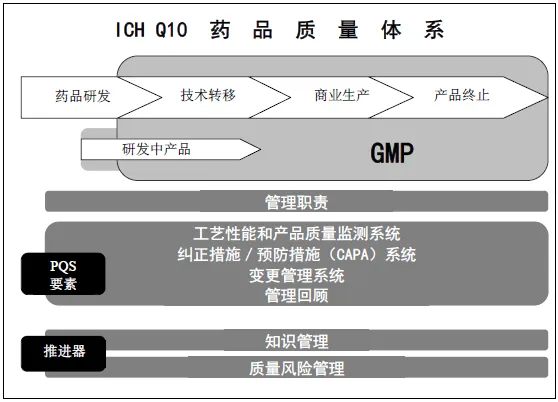
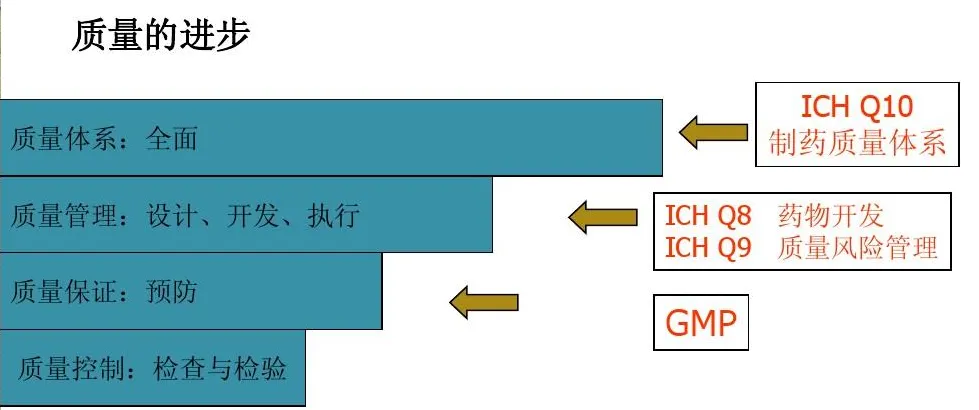
图1为ICH Q10药品质量体模型示意图
研发质量体系的建立也要参考商业化生产的质量体系,但不能完全拿来主义,因为有些商业化生产的质量管理体系文件,并不适用于研发质量,会造成与实际脱节。研发质量体系要兼顾研发阶段的特点也要考虑不同药品在后期申报和上市阶段对前期的法规要求。
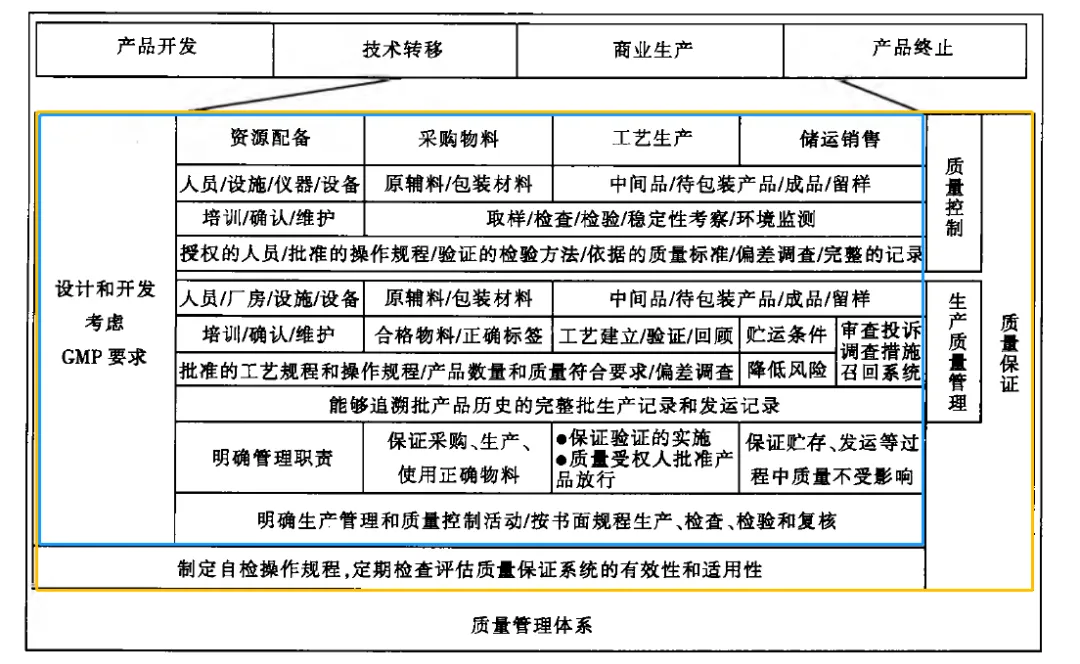
图2为GMP与产品生命周期和质量体系对应关系
建立研发质量体系时要平衡好技术创新和法律规范之间的平衡,一味追求技术创新,但不符合法律规范,这样不行,但完全追求规范操作,扼杀了技术创新,也失去了研发的原本意义,因此在建立研发质量管理体系的团队成员,要有懂研发,懂法规,懂质量管理,懂注册的专业人士,需要共同做出决策。
研发质量体系建立/维护/审核/改进就是一个PDCA循环,只有闭环才能持续提高。按“写你所做,做你所说,记你所做,改你所错”,通过纠正预防持续改进,不断完善质量体系,使之更符合法规要求,科学合理,可操作。
对于研发质量体系的建立,需要有三个不可或缺的要素:程序、资源、运行。要制定相应的程序,同时配备足够的资源,最后能保证顺利的运行,这样才能是一个完整的体系。也正是研发的不确定性很大,很多情况是不可预见的,所以在研发中产生的偏差、变更、CAPA、OOS等的执行也不一致,不同阶段有不同的处理原则和方法,越往后越严!
建立完善的药品研发质量管理体系是保证药品研发质量和成功注册的基础。药品研发企业要从战略上重视研发质量管理体系的建设和完善。企业只有完善药品研发质量体系,才能提高企业核心竞争力,让企业立于不败之地。
参考文献
1.ICH Q10 药品质量体系
2.ICH Q8(R2) 药物研发
3.ICH Q12 生命周期管理
4.临床试验用药物生产质量管理规范
5.药品生产质量管理规范
6.药品GMP指南
《免责声明》
凡本平台转载的所有的文章、图片、音频、视频文件等资料的版权归版权所有人所有,仅用于个人学习及科普推广,采用的非本平台原创文章及图片等内容无法一一与版权者联系。如果本平台所选内容的文章作者及编辑认为其作品不宜上网供大家浏览,或不应无偿使用请及时用函告或电话通知我们,以迅速采取适当措施,避免给双方造成不必要的经济损失。