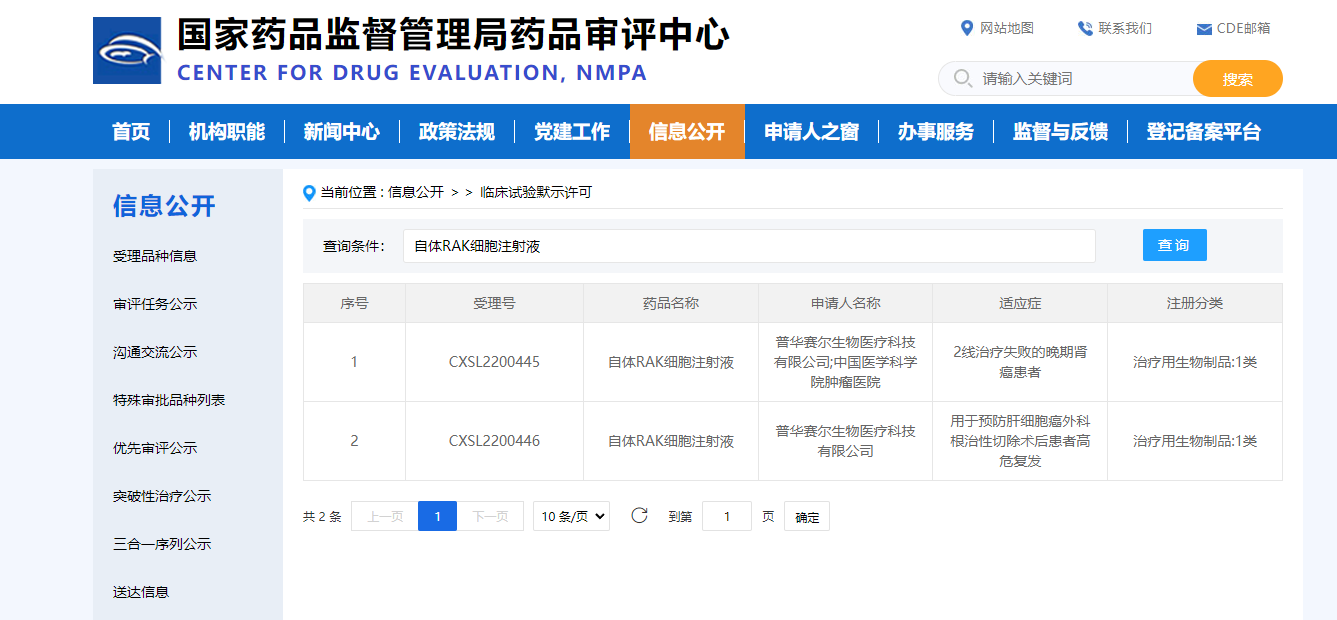
2022年11月29日,国家药监局药品审评中心(CDE)官网显示,我司创新生物制品自体RAK细胞注射液(受理号:CXSL2200445、CXSL2200446)正式获得国家药品监督管理局(NMPA)的临床试验默示许可。自体RAK细胞注射液获批适应症为2线治疗失败的晚期肾癌患者,以及用于预防肝细胞癌外科根治性切除术后患者高危复发。
关于自体RAK细胞注射液
“自体RAK细胞注射液”是利用T细胞自身具有识别和杀伤肿瘤细胞的能力,通过采集人体自身免疫细胞,经过体外培养,使其数量倍增,杀伤功能增强,然后再回输到人体循环系统来杀灭人体中的病原体、癌细胞、突变、衰老的细胞,打破免疫耐受,激活和增强机体的免疫能力。在各实体肿瘤的过继细胞免疫治疗均有明显效果。
关于二线治疗失败的晚期肾癌
肾癌是常见的泌尿系统恶性肿瘤之一,约占成人肿瘤的3%-5%,在我国泌尿系统肿瘤中发病率位列第3,其中80%-90%的肾脏恶性肿瘤为肾细胞癌。早期肾癌症状不明显,20%-30%的患者就诊时已是晚期,局限性肾癌术后仍有30%出现复发或转移,5年生存率不到10%。
关于用于预防肝细胞癌外科根治性切除术后患者高危复发
原发性肝癌是临床上最常见的恶性肿瘤之一,全球每年新发肝癌患者超90万例,在所有癌症中排第6位;肝癌死亡人数为83万例,在所有癌症中排第3位。据GLOBOCAN 2020统计,中国是世界上肝癌发病率最高的国家之一,超8.9人/10万人,是名副其实的“肝癌大国”。尽管手术是解决肝癌的主要手段,但是术后高复发率仍是一个不可忽视的问题。研究显示,肝细胞癌根治性切除术后5年内复发率为40%-70%,其中术后2年内复发率最高,高于60%,且大多数复发的患者预后较差。
关于普华赛尔
普华赛尔致力于新药研发,公司在研产品有4个,管线达15条,各产品在抗肿瘤、神经退行性疾病、代谢性疾病、慢性炎症性疾病、性功能障碍等方面均有飞跃发展。普华赛尔联合创始人杜仲义表示:“希望做一款老百姓都能用得起的细胞治疗药物,为广大的肿瘤患者治疗提供更多的治疗选择。”

本次两个适应症均获得国家药品监督管理局(NMPA)的临床试验默示许可对于公司全体员工都具有积极的鼓舞作用,是公司全新发展的开始,是公司具有重要意义的里程碑事件之一。